
馬爾文帕納科
 白金會員
白金會員 已認證
已認證

馬爾文帕納科
 白金會員
白金會員 已認證
已認證
本文由馬爾文帕納科粒度應用專家劉曉華供稿
本文摘要
對于病毒的研制和生產,了解不同階段的病毒濃度,以優化克隆或生產產量是很重要的。DLS(動態光散射)技術可用于病毒開發,以測量藥物物質或用于篩選功能,將良好和穩定的樣品與含有污染物或聚集物的樣品分離開來。在Zetasizer Ultra納米粒度電位儀上使用多角度動態光散射 (MADLS)進行顆粒濃度測量,現在可以在幾分鐘內獲得每個群組的粒徑和粒徑分布以及顆粒濃度。
本文數據來自于Allergan對Zetasizer Ultra的評估測試的分享,展示了三種腺相關病毒(AAV)樣本的實例。并將濃度結果與基于衣殼酶聯免疫吸附實驗的病毒滴度測定結果進行了比較。
儀器:Zetasizer Ultra納米粒度電位儀
樣品池:使用小體石英樣品池(ZEN2112)測量樣品。使用MADLS測量顆粒濃度,可以得到粒徑大小分布和每個峰的濃度。測量時,需要用戶提供以下參數:
樣品材料:因為病毒衣殼是由蛋白質外殼制成,測量是以蛋白質作為樣品材料。
分散劑材料:最初分散劑設置為水,但隨后通過編輯顆粒濃度結果來修正粘度以獲得正確的尺寸和濃度。測量粒度的準確性對顆粒濃度的計算至關重要。緩沖液的粘度是用玻璃微珠來測量的[1]。需注意,較大的顆粒散射更多,無需向樣品中大量添加。
緩沖散射計數率(背向散射角):緩沖散射強度在用于測量的同一樣品池(ZEN2112)中測量,只需使用背向散射角設置單角度測量,并將測量位置設置在比色皿的中心。作為正常測量運行,導出的計數率值用于“緩沖散射”領域的顆粒濃度測量。
三次重復測量的運行時間小于4分鐘。
02丨測量結果
三種AAV樣品的粒徑大小分布如圖1,圖A至C所示。相應的顆粒濃度如圖2,圖D至F所示。圖1,圖A所示的ATCC AAV2參考樣品含有聚集體,這并不奇怪,因為該樣品是從冷凍中解凍的,由于可用體積小,直接插入試管中,沒有任何預過濾。然而,盡管存在聚集體,基于MADLS技術測量的顆粒濃度給出了一個濃度值(1.12 x 1012顆粒/ml)與衣殼酶聯免疫吸附試驗(0.92 × 1012粒/ml)相關良好。關于濃度更多細節見表1。對于Allergan的兩個AAV樣本,檢測到的聚集物少得多或為零,從表1中可以看出,兩個樣本中病毒峰值的濃度值與衣殼ELISA結果具有良好的相關性。

圖1 三個樣品中的每一個的三次重復測量如圖所示:圖A-ATCC AAV2參考樣品,圖B-Allergan AAV樣品1和圖C-Allergan ADP樣品2

圖2 與圖1中相同的三個樣品的三次重復測量的分布顆粒濃度:圖D-ATCC AAV2參考樣品、圖E-Allergan AAV樣品1和F-Allergan ADP樣品2
為了比較變化,取每次重復測量的濃度結果,計算標準差和平均值,以此計算%CV。
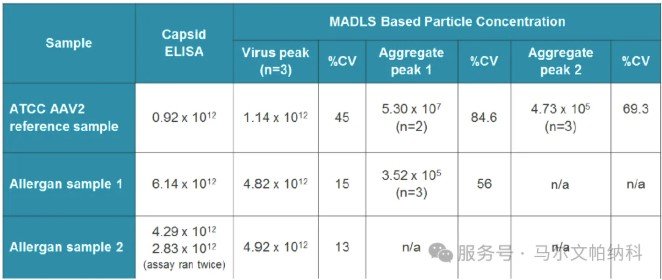
表1 三個樣品的衣殼ELISA測定濃度數據和基于MADLS的顆粒濃度結果;ATCC AAV2參考樣品、過敏原樣品1、過敏原樣本。2、所有濃度均以顆粒/毫升為單位。n=表示在三次重復測量中,有幾次測到了峰值。如果不存在群體峰值,則標注為n/a,即“不適用”。
比較表1的結果,ATCC AAV2參考樣本的病毒種群濃度值CV %最大。這是由于樣品中的聚集體影響了AAV峰值的確定程度。如果您將圖1A中的大小峰值可重復性與圖1B或1C中的其他病毒種群峰值進行比較,您可以看到后者覆蓋得更好,可重復性更高。這將直接影響濃度測量的重復性。兩種Allergan AAV樣品的峰值重復性約為15%,樣品中沒有或只有少量聚集物。
結論:
所提供的數據表明,Zetasizer Ultra基于MADLS的顆粒濃度既可以提供AAV病毒樣本的大小分布,從而報告樣本聚集狀態,也可以提供有關主要病毒群的濃度和存在的任何聚集的信息。每次重復測量不超過4分鐘,樣品可以在試管內進行整個測量,因此污染的風險最小,暴露給操作人員的風險也最小。
作為最后的注意事項,在測試期間,確定使用正確的樣品粘度以確保最準確地測量顆粒濃度是很重要的。分散劑的粘度可以用粘度計測量,也可以在Zetasizer Ultra儀器中使用粒徑參考珠來測量[1]。
參考文獻:
[1] Determining Dispersant Viscosity Using Dynamic Light Scattering; Malvern Panalytical Application Note
相關產品
更多
相關文章
更多
技術文章
2025-06-20技術文章
2025-06-20技術文章
2025-06-19技術文章
2025-06-10
虛擬號將在 秒后失效
使用微信掃碼撥號