中國粉體網訊
1形態
通過光學顯微鏡、掃描電子顯微鏡(SEM)或者透射電子顯微鏡(TEM)觀察微球的形態,微球形態與結構的不同對微球的載藥量以及釋放行為有顯著影響[1]。表面粗糙的微球易吸附藥物結晶,往往會導致高突釋。通過對微球形態的觀察,總結不同工藝處方對其形態的影響,同時優化制備工藝及處方,還可以改善微球的釋放行為。
SEM是目前觀察微球形態使用最廣泛的方法,被用于表面及切面形態的觀察(見圖1)。TEM 分辨率高,圖像為二級結構平面,適用于亞微球、納米球粒徑測定。此外還有原子力學顯微鏡(atomic force microscopy,AFM)可用于觀察微球形態,AFM 優點之一是分辨率高,與 SEM 相比,不需要對樣品進行金屬噴鍍,避免了噴鍍后對樣品的表面形態造成的破壞,并且AFM 允許在液態環境下觀測樣品,而 SEM 則不行。但是 AFM 缺點是觀察范圍窄,得到數據不具有統計性,適合單個粒子表面形態的觀察。

圖1 SEM觀察的PLGA-Glu微球圖像
(A)全視圖 (B)單個微球表面圖 (C)單個微球切面圖
2粒徑及分布
粒徑大小及其分布是影響微球制劑釋放行為的關鍵因素。粒徑測定的方法有多種,動態光散射(DLS)、激光衍射法(LLD)、TEM、SEM、AFM等。粒徑的分布除了可用粒徑分布圖表示,還可用多分散性指數( polydispersity index,PDI) 和跨距表示[2]。跨距與多分散性指數數值越小,表示粒徑分布越均勻。
3載藥量/包封率
載藥量和包封率是反映微球制劑中藥物含量的重要指標,載藥量的批間穩定性是工藝成熟的重要標志,也是衡量制備工藝和成本的重要指標[3]。
載藥量和包封率的計算都需要建立在藥物含量測定的基礎上,目前上市的微球制劑所用載體多為聚乳酸-羥基乙酸共聚物(PLGA)。由于 PLGA 易溶于二氯甲烷、三氯甲烷、二甲亞砜等有機溶劑,而不溶于水、醇。依據藥物和 PLGA 的溶解性質,PLGA 微球常用的含量測定方法有:
① 先用有機溶劑溶解 PLGA 和藥物,再用不溶于 PLGA 溶劑沉淀 PLGA,經過離心或過濾后,取上清進液相測定含量;
② 先用有機溶劑溶解 PLGA 和藥物,再加入醋酸鹽緩沖液等溶劑提取多肽后進樣分析;
③ 溶劑溶解 PLGA 及藥物后,直接進樣測定。
方法①和②需要在測定之前將高聚物與藥物分離,而且分離過程使用的試劑容易導致藥物損失。方法③的優勢在于無需將高聚物與藥物分離,但是應用較少,需要使用質譜等特殊儀器。
4釋放行為、突釋效應和滲漏率
1) 釋放行為
在載藥微球的研發階段,應確定好合適的體外釋放條件,并根據體內釋放條件建立體內、體外相關性。對于釋放周期較長的載藥微球,可以建立加快釋放試驗的方法,預測模擬常規釋放行為[4]。建立加速釋放的條件要遵循相關性原則,使加速釋放曲線盡量擬合常規釋放曲線,得到準確的相關性。
釋放行為是根據臨床適應癥需求和高分子聚合物材料性質共同決定的。選擇合適的高分子聚合物材料與工藝制備不同結構的載藥微球,使活性成分按照預期的藥代動力學模型釋放。對于可生物降解材料,溶脹和溶蝕機制也是控制藥物釋放的主要因素。釋放介質的組成、pH 值、離子強度、滲透壓和溫度等都會對釋放速率產生影響。
2) 突釋效應
在微球釋放的最初階段,吸附在微球表面的藥物會通過擴散作用而快速釋放,稱為突釋效應[5]。突釋效應可能導致人體內藥物濃度在短時間內迅速升高,并使得藥物效期縮短,是限制微球廣泛應用的關鍵問題,因此在質量控制過程中必須重點關注突釋率這一指標。目前主要通過體外釋放度實驗考察微球的突釋效應。
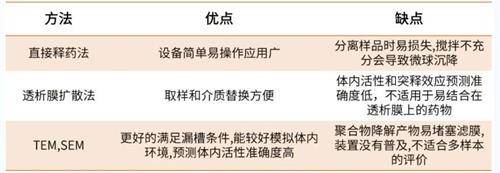
2020 版《中國藥典》明確規定載藥微球在前 0.5h 內釋放的藥物含量要低于40%。緩釋微球制劑的體外釋放方法,目前并沒有統一的標準要求,目前報道的微球制劑體外釋放度測定方法主要有:
① 直接釋藥法,這是目前最常用的方法,包括搖床法和恒溫水浴靜態法。
② 流通池法,此法已被美國藥典收載,被廣泛應用于緩釋制劑的研究。
③ 透析膜擴散法,該法是指將微球放入透析管中,并將其放入介質中測定。3種方法優缺點比較見表1。
表1 微球制劑體外釋放度實驗方法的比較
除了改進體外釋放度的實驗裝置,還可以通過調節釋放介質溫度、pH值、離子強度、攪拌速率以及使用表面活性劑、酶等方式能實現微球體外加速釋放,而達到縮短檢驗周期,提高檢驗效率的目的。
3) 滲漏率
微粒制劑應檢查滲漏率,可由下式計算:
滲漏率=產品在貯存一段時間后滲漏到介質中的藥量/產品在貯存前包封的藥量×100%
5有關物質和雜質分析
鑒于已上市的產品大部分為多肽微球,其相關雜質包括降解雜質、工藝雜質以及聚合物雜質:
降解雜質包括藥物在生產、儲存過程中發生水解、氧化反應而生成的產物。
工藝雜質中得到最廣泛關注的是乙酰化雜質,這類雜質是由藥物多肽中的氨基、羥基與PLGA的羧基末端經過化學反應生成的,這種雜質目前在PLGA微球中廣泛存在。乙酰化雜質的產生與多肽自身結構有關,質譜和毛細管電泳技術聯合使用可用于其他多肽微球的乙酰化雜質檢測。
聚合物雜質包括多肽或蛋白自身相聚合形成的雜質,以及聚合物-多肽雜質。
6Zeta電位測定
Zeta電位也是微球的一個重要屬性,Zeta電位往往能指征微球制劑的穩定性,而這一指標卻容易被忽視。在微粒分散體系的溶液中,其表面帶有同種離子,通過靜電引力吸附和擴散作用,在微粒周圍形成的吸附層與相鄰的擴散層共同構成微粒的雙電層結構,從吸附層表面至反離子電荷為零處的電位差叫動電位,即Zeta電位。Zeta電位值可以反映微粒的物理穩定性,Zeta電位越大,微粒之間的排斥作用越強,絮凝或沉積的可能性越小,微粒在溶液中越穩定。一般Zeta電位絕對值大于15mV,可以達到穩定性要求。
7有機溶劑殘留
生產過程中引入的油相(有機溶劑)在固化的過程中會存在未能完全除去的問題,如丙酮、乙酸乙酯、二氯甲烷等殘留,不僅影響微球儲存的穩定性,還會在注射后引起人體的副作用,因此必須對其限度進行控制。
殘留溶劑一般采用氣相色譜法來測定。此外,對于固體無菌粉末制劑,一般都要求控制水分的含量。由于微球制劑大都是多肽或蛋白類藥物,這類藥物對熱不穩定,因此不適合采用干燥失重的方法測定水分,可以采用卡爾-費休氏水分測定方法來完成。
8微生物檢查
微球制劑的細菌內毒素和無菌檢查,需要進行球內和球外部檢測實驗,一般凍干制劑要求更加嚴格。微球的粒徑遠大于真菌和細菌,因此表面及內部均存在污染可能。
微球外部實驗,旨在檢測制劑完成生產灌裝入瓶中時的微生物和細菌內毒素; 微球內部實驗,旨在檢測微球內部包含的微生物和細菌內毒素。
可采用直接接種法對利培酮微球內部和外部進行無菌檢查,在內部無菌檢查過程中,先用2 mL 二甲基亞砜將微球溶解和破碎,將溶解后全部液體接種至20 mL 培養基中,運用顯微鏡觀察溶解和培養過程[6]。
這種內部檢查方法經方法學驗證表明各驗證菌生長情況良好,使用濃度小于10% 的二甲基亞砜不會影響微生物的生長,可應用于微球制劑的無菌檢查。
9載體輔料特性檢測
微球制劑的緩釋功能是通過載體輔料實現的,這些載體輔料通常無毒、可降解且具有良好生物相容性。最常用的微球關鍵輔料包括聚乳酸、聚羥基丁酸酯、聚乳酸-羥基乙酸共聚物等。此類輔料的黏度、分子量及分布范圍、組成單體的比例、單體殘留量、酸值、及玻璃轉化溫度等指標都會影響微球的釋放周期和釋放速度。
(中國粉體網編輯整理/青黎)
注:圖片非商業用途,存在侵權告知刪除


















