中國粉體網訊 在現有的儲能技術中,鋰離子電池(LIB)具有無與倫比的能量密度和適配性。自1991年首次商業化以來,LIB的增長持續由便攜式設備推動。然而,近年來,LIB開始應用在大規模電動汽車和固定式儲能方面。由于LIB原料礦床分布不均,容易出現價格波動,新的應用給LIB產業鏈帶來了前所未有的壓力,進一步導致了對其替代儲能電池的需求。鈉離子電池(SIB)是最有前途的儲能技術之一。在本文中,討論了SIB商業化的前景及關鍵與挑戰。通過比較LIB和SIB的技術演變,揭示了兩種電池技術之間的主要差異。基于在動力、可循環性和安全性方面的出色表現,SIB商業化之路迫在眉睫。
1. 背景
2019年是鋰離子電池取得最高成就的一年,因為John Goodenough、M. Stanley Whittingham 和 Akira Yoshino獲得了諾貝爾化學獎,這是對鋰離子電池多功能儲能設備的發明者的表彰。誠然,只有三位獲獎者是諾貝爾委員會的限制,我們必須同樣感謝其他科學家,其中一些將在本文中提及,他們的工作帶給了我們上個世紀人類最偉大的成就之一。
基于上述諾貝爾獎獲得者的研究,LIB于1991年被SONY商業化,并立即實現了兩位數的銷售額增長率。LIB市場份額僅用了6年就超過了當時現有的電池技術,如鎳鎘電池和鎳金屬氫化物電池。這種驚人的增長來源于便攜式消費電子設備(例如卡座錄音機、唱片機、個人護理設備和移動電話)的興起。LIB的輕質和高能量密度特性使其成為這些設備的理想選擇。這也意味著LIB和當時現有的電池技術之間沒有直接競爭。例如,日本鎳鎘電池和鎳金屬氫化物電池的銷售額并沒有因為LIB銷售額的指數增長而下降。顯然,一個新的細分市場已經出現。
自從第一個商業LIB出現以來,便攜式消費電子產品在形式和功能上都發生了巨大的變化,集成電路上的晶體管數量大約每兩年翻一番。這意味著,計算速度大約每兩年翻一番,最終產生了智能設備。運行這些復雜設備所需的電池能量密度也有所增加,但增長速度較慢。這是因為能量密度受基本的化學性質所限,增加電池的能量密度已被證明是一個巨大的挑戰。盡管如此,仍有改進其他電池性能的空間,例如成本、循環穩定性、安全性、環境友好性和電池設計方式。
LIB的一個突出特點是能夠不斷發現新的應用領域。最近,由特斯拉公司、比亞迪和日產率先推出的純電動汽車已成功完全商業化,并由LIB提供動力。搭載 100kWh車載電池組的Tesla Model S行駛里程為600公里,獲得了美國環保署認證。全球電動汽車和電動公共汽車數量目前為400萬輛,預計到2028年這一數字將達到5000萬到兩億。這種普通汽車向電動汽車的轉變是由清潔能源政策推動的。
在固定儲能領域,預計將安裝更多兆瓦時規模的LIB。雖然在這些領域中,電池重量和占地面積不是主要考慮因素,但預計LIB還是將發揮主導作用。這是因為LIB的其他性能指標,如循環效率、高功率和深度放電能力,是盈利性電網儲能的重要要求。
雖然鋰離子電池技術沒有明顯的性能限制,但碳酸鋰和鈷酸鋰等原材料的來源變得越來越困難。隨著電池組尺寸和安裝數量的增加,原材料公司發現越來越難以滿足需求。例如,2015年,由于電動汽車行業的需求,碳酸鋰的價格在10個月內上漲了近兩倍。而且碳酸鋰稀缺且分布不均——2015年全球產量的近一半來自南美洲。對于一個經濟利益迅速增加的原材料來說,由于全球供應風險短缺和源頭過度開發,勢必會出現問題。此外,鋰離子電池的其他重要成分鈷和石墨被歐盟(EU)列為關鍵原材料。因此,最近LIB的大規模部署給已經擁擠的價值鏈帶來了更大的壓力,導致價格波動。因此,有必要且必須急迫地投資于鋰技術之外的替代研究工作,以克服對稀缺資源的過度依賴。
幸運的是,在過去十年中,對鈉離子電池的研究興趣大增。這主要是因為SIB從根本上擁有最與LIB性能相匹配的潛力。鈉和鋰是第一主族元素(也稱為堿金屬元素)的兩個相鄰成員。它們在價殼中都有一個松散的電子,因此很容易形成第一氧化態Li+ 和 Na+。作為電化學載體,Li+和Na+在標準電極電位方面沒有太大區別:Na(-2.71 V 對標準氫電極(SHE))僅比 Li(-3.04 V 對 SHE)高300mV。在發現和開發鋰插層化合物的同時,鈉化合物的結構和電化學性質也得到了同等的探索。盡管鋰化合物顯示出優異的電化學性能,但與鋰相比,鈉的可用性和成本預計將改變目前鋰一家獨大的場面。然而,由于早期LIB電池的產量相對較小,鋰生產限制從未被測試過。此外,電池能量密度在便攜式電子設備應用中至關重要。因此,LIB 的研究和商業化呈指數級增長,這在某種程度上以犧牲SIB的研究為代價。然而,在過去十年中,由于對鋰供應短缺的擔憂以及對替代性、可持續電池技術的需求,SIBs的研究得到了真正的復興。
最近SIB的研究復興使得在鈉插入化合物方面取得了顯著的發現。SIB發展如果能成功商業化,同樣能對清潔能源轉型作出重大貢獻。在本文中,我們分析了推動基于鋰和鈉的室溫可充電電池不同發展路徑的驅動力。特別關注基于候選室溫有機電解質的SIBs的特性,以回答以下問題:SIBs可以取代 LIBs嗎?對于感興趣的讀者,最近出現了一些關于SIB 和LIB的深入評論。SIBs的顯著進步歸功于固態材料的科學知識,而這些知識是在開發LIBs時獲得的。此外,電極結構的相似性使得SIB和LIB的工業加工技術相同。這種積極因素的結合使 SIB 技術的發展順風順水,有望給SIB帶來商業成功。
2.SIB 和 LIB 的共同歷史
關于鈉離子電池的研究至少可以追溯到20世紀70年代,幾乎與鋰離子電池的研究同時起步。在研究早期,鋰離子電池和鈉離子電池有著類似的研究歷程。Whittingham于1976年首次報道了層狀TiS2與鋰在Li//TiS2電池中的可逆電化學嵌入反應。其發現鈉和鋰同樣能夠嵌入TiS2以及其他過渡金屬二硫化物中。由于TiS2正極的低開路電壓(約為2.2V),以及金屬鋰負極導致的不穩定性,Li//TiS2電池無法開發成具有商業化前景的功能性電池。這是鋰離子/鈉離子電池研發的第一個主要挫折。
為了解決正極低電壓的缺點,Goodenough等在20世紀80年代提出了使用層狀金屬氧化物作為電池正極。其化學成分對于鋰離子電池是LiMeO2,對于鈉離子電池則是NaMeO2(Me代表Co、Ni、Cr、Mn 或 Fe)。NaMeO2化合物的發現歸功于Delmas等在20世紀80年代初期的開創性工作。在電池電壓方面,Goodenough的發現是具有突破意義的。例如,LiCoO2的開路電壓為4.0 V,幾乎是TiS2的兩倍。一般來說,鋰基化合物的電化學性能優于鈉基化合物。
然而,換了新的正極材料的鋰離子/鈉離子電池,選擇的負極仍然是金屬鋰或鈉。這些活潑金屬負極會與電解質反應,導致電池不穩定。此外,在嵌入和脫嵌周期中,金屬負極的枝晶會不受控制地生長。枝晶生長是引起電池內部短路和火災的主要原因。出于安全原因,金屬負極并不是一個好的選擇。作為替代方案,Scrosati提出了一種低壓嵌入型負極來代替金屬負極。這標志著“搖椅”電池的誕生(見圖5)。搖椅式電池是一種電池的設計概念,其創新之處在于:它用嵌入化合物代替了鋰金屬,電池兩極都由嵌入化合物充當。這樣,兩邊都有空間讓鋰離子嵌入,在充放電循環過程中,鋰離子在正負電極來回嵌入與脫嵌,就像搖椅一樣搖擺,因此得名。就鋰離子而言,Yazami和Touzain發現鋰離子能夠在理想的低電壓和高重量容量下嵌入碳質材料。因此Yoshino使用軟碳負極和LiCoO2正極制造出了第一個可以較好工作的鋰離子電池,該電池于1991年由日本SONY公司商業化。可惜的是,在鈉離子的情況下,由于鈉離子的半徑比鋰離子大,鈉離子在軟碳和石墨難以發生嵌入和脫嵌,導致相同材料的鈉離子電池的容量比起鋰離子電池大約只有十分之一。這成為鈉離子電池商業前景的瓶頸和第二個主要挫折。
在SONY做出主要研發生產鋰離子電池的決定后,1990年至2000年期間,鈉離子電池研究數量急劇下降。同期,鋰離子電池的市場份額和價值飆升。這期間內,鈷的價格曾大幅上漲,后因美國政府庫存的銷售而有所緩和。鈷儲量的稀缺性促使人們尋找更便宜的替代品。這促使了新型金屬氧化物結構的合成,例如尖晶石型電極 LiMn2O4和橄欖石型磷酸鐵鋰 LiFePO4。研究還發現氧化鎳中的Co取代增加了結構穩定性,于是在2000年底,混合金屬氧化物材料被用于電池中,如LiNi1-x-yCoxAlyO2和LiNi1−x−yMnxCoyO2。
盡管常溫鈉離子電池的研究大幅下降,但高溫鈉離子電池卻得到了深入發展。福特汽車公司首先發起,然后與東京電力公司和日本NGK公司聯合開發了在300至350℃之間運行鈉硫電池系統。緊接著,鈉硫電池的溫度稍低的變體,鈉-氯化鎳電池,通常稱為zebra電池首次出現。zebra電池在250至300℃之間運行,最初由Zeolite Battery Research Africa開發,ZEBRA的名稱由此而來。這些電池系統的一個共同特點是采用了熔融鈉負極和陶瓷隔板。高溫鈉離子電池的應用領域包括固定電網儲能、電動汽車和太空領域。高溫鈉離子電池的應用證明了大規模鈉基儲能的可行性。然而,高的工作溫度帶來了其他問題,例如腐蝕問題,安全問題和低能量效率。
2000 年,Stevens和Dahn發現了鈉離子在硬碳材料中有良好的嵌入性能,從而重新引起了人們對室溫鈉離子電池的興趣。鈉離子電池中的硬碳負極具有低電壓和300 mAhg-1的高質量容量,接近鋰離子電池中的石墨(372 mAhg-1)。盡管這一發現被證明是鈉離子電池研究興趣重燃的轉折點,但它并沒有立即引發商業化研究的熱潮。這是因為當時顯然缺乏替代鋰離子電池的需求動力。一項基于專利的分析表明,鈉離子電池專利申請量的大幅上升是在12年后的2012年才開始的。由此可以發現,鈉離子電池取代鋰離子電池的驅動力主要是由于鋰離子電池的大規模應用帶來的供應短缺的風險。2010年以來,鈉離子電池正極材料研究取得了前所未有的進展。2010年至2013年3年間報道的正極材料總數幾乎等于之前存在的總數。鈉離子電池正極材料的三個主要類型是層狀金屬氧化物、聚陰離子化合物和普魯士藍類化合物。選材的目標是制造廉價的鈉離子電池,但需同時具有與鋰離子電池相近的性能特征。這解釋了在正極材料的組成中盡量選擇了地球上豐富的元素,如鐵、錳和鎂。至于負極,硬碳(HC)仍然是突出的選擇,因為其前體便宜且豐富。
2015年,由法國國家科學研究中心(the French National Center for Scientific Research,CNRS)建立的法國研究網絡(the French network for electrochemical energy storage,RS2E),法國替代能源和原子能委員會 (the French Alternative Energies and Atomic Energy Commission,CEA) 以及法蘭西學院(the Collège de France)合作開發了第一批“18650”(直徑18毫米,高度65毫米)圓柱形鈉離子電池。鈉離子電池商業化巨大飛躍開始主要由這些初創企業帶動,此后出現了十多家研發鈉離子電池的公司。率先開展這些工作的是Faradion、Tiamat和中科海鈉。英國的Faradion成立于2011年,是最早將鈉離子電池商業化的公司之一。目前,Faradion正在開發和推動硬碳負極的1-5 Ah鈉離子軟包電池,該電池使用的是層狀金屬氧化物正極Na1.1Ni0.3Mn0.5Mg0.05Ti0.05O2(NMMT),和商用硬碳負極。法國的Tiamat是RS2E的衍生公司,成立于2017年。該公司繼續沿用基于聚陰離子復合正極Na3V2(PO4)2F3(NVPF)和硬碳負極的圓柱形鈉離子電池的道路。根據其官方網站,Tiamat已經生產了超過10000個鈉離子電池。最后,中國的中科海鈉公司成立于2017年,是中國科學院物理研究所的附屬公司。中科海鈉目前生產基于專有Na0.9[Cu0.22Fe0.30Mn0.48]O2正極和無煙煤基硬碳負極的鈉離子軟包電池。2019年4月,中科海鈉宣布了迄今為止最大的鈉離子電池模塊,功率為100kW。圖1闡述了 LIB 和 SIB 的共同歷史和技術演變。
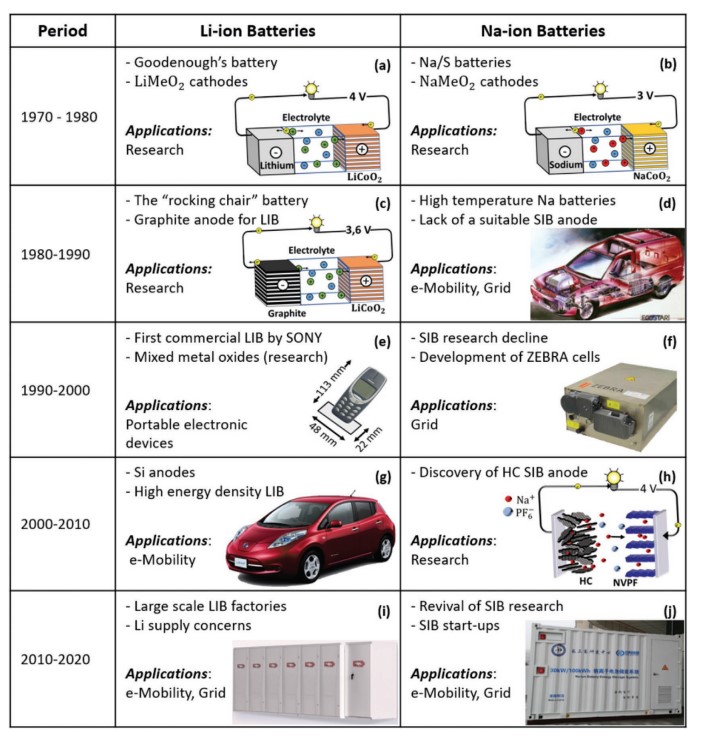
圖1 LIB 和 SIB 的共同歷史: a) Li//LiCoO2 電池的圖示。 b) Na//NaCoO2 電池的圖示。 c) 石墨//LiCoO2 電池的圖示。 d) 福特Ecostar的插圖,設計用于使用NaS電池。 e) 由LIB驅動的諾基亞3310便攜式設備。f) 用于電網儲能應用的商用ZEBRA電池。 g) 由LIB提供動力的 2010年 Nissan Leaf 模型。 h) 硬碳//Na3V2(PO4)2F3電池的圖示。 i) 網格規模的LIB安裝示意圖。 j) 在中國溧陽市安裝的中科海鈉 SIB。
3.SIB和LIB的比較
如上所述,LIBs 和SIBs 的電化學性質是相似的。 因此,可以在兩種電池系統的生產中使用相同的制造工藝和協議。這意味著,如果LIB制造商決定生產SIB,他們將不會產生額外的資本支出。因此,SIB的制造被描述為“直接替換”,這在一定程度上解釋了該技術驚人的發展速度。SIB的下一個前沿是在大規模和新興應用中“直接替換”LIB。為此,它們需要達到或超過LIB的性能指標,包括功率、能量密度(體積和重量)、可循環性、安全性和成本。
3.1 物理特征
從外觀來看,SIB和LIB之間沒有太大區別。圓柱形LIB通常為18650格式,類似的SIB目前由Tiamat生產。據我們所知,迄今為止,他們仍然是圓柱形SIB 的唯一制造商(譯者注:此處存疑)。其他制造商大多選擇了軟包電池。
在電池內部,除了化學成分外,復合電極涂層看起來也很相似。這是因為在兩種電池化學中都使用了相同的導電碳填料和粘合劑材料。唯一的物理區別是集流體的選材。在LIB中,銅箔和鋁箔分別用作陽極和陰極集流體,而在SIB中,兩個電極的集流體均選用鋁箔。這是因為鈉不會與陽極的鋁集流體形成合金。這降低了SIB的材料成本和重量,因為鋁比銅更便宜且密度更低。圖2a、b分別顯示了LIB和SIB的主要組件的示意圖。
使用相同的集流體還有其他優點。其中最主要的是能夠在0V下放電和存儲SIB,而不會降低容量。Faradion已通過其在0V下安全儲存和運輸鈉離子電池的專利證明了這種高度安全的特性。另一個優點是易于回收SIB,其中集流體、接線片和外殼完全由鋁箔構成,箔分離步驟更容易。另外將電池組安全放電至0V的能力可減少漏電和起火爆炸風險。最后,制作SIB雙極性電池會變得很容易,并開辟了高壓SIB電池的可能性。
3.2 電解質
LIB和SIB中使用的非離子電解質溶劑是相同的。從成本的角度來看,這是一個優勢:SIB可以使用更便宜的非離子電解質溶質。LIB和SIB常用的溶劑包括碳酸亞乙酯 (EC)、碳酸亞丙酯 (PC)、二甲氧基乙烷 (DME) 和碳酸二甲酯 (DMC)。需要兩種或三種溶劑的混合以獲得最佳的電解質特性,如粘度、電導率和電化學穩定性窗口。目前已經對SIB和LIB的電解質優化進行了系統的研究。
SIB與LIB電解質的差異出現在溶質的鹽中。LiPF6是LIB中最常用的鹽,而NaPF6則經常用于SIB。典型的鹽濃度為1M(即1mol dm-3),這是由于該濃度下有著最佳的電導率和粘度。曾有一些使用NaClO4鹽的失敗嘗試,由于存在爆炸危險而被放棄。早期的NaPF6鹽存在純度問題,導致電解質混濁,這對半電池和鈉參比電極的性能產生了負面影響。這些是開發新電池化學的一些實際挑戰。盡管如此,高純度的電池級NaPF6的市售價格仍然要比LiPF6便宜四倍以上。相比之下,LiPF6的價格約為8.9歐元每克,而NaPF6的價格約為2.2歐元每克(Sigma-Aldrich,2020年500克的價格水平)。這種價格差異是由于上游堿金屬碳酸鹽(Li2CO3和 Na2CO3)的成本不同,盡管這兩種鹽的合成路線相似。
3.3 能量密度、功率和可循環性
自成立以來,SIB已證明其能量密度可與商業LIB相媲美。第一代18650電池的能量密度為90Wh kg-1,這已經令人印象深刻,而Faradion和Novasis Energies 的軟包電池SIB分別具有約150和130Wh kg-1的能量密度。作為參考,第一個 SONY LIB的能量密度為80Wh kg-1,而最先進的LIB的能量密度約為150-200 Wh kg-1。
盡管目前最先進的SIBs的能量密度在目前LIBs的較低范圍內,但可以預期隨著新的陽極和陰極材料的發現和改進,就像LIB技術的發展一樣,SIB的能量密度也將得到提高。除了這一預期之外,SIBs的功率輸出能力一直非常出色,在某些情況下甚至優于LIB。圖2c列出了55Wh kg-1圓柱形SIB在室溫下的功率輸出性能。這些功率優化的SIB能達到10C的速率(即在6分鐘內完全放電),容量保持率為84%。Novasis Energies的軟包電池顯示出同樣出色的倍率性能,即同樣10C倍率和84%的容量保持率。
另一個性能指標是電池的可循環性。電動汽車電池測試標準將電池壽命終止定義為剩余80%的初始/標稱容量保持率。已知不同的溫度條件、放電/充電率和放電深度(DoD)會影響電池壽命。LIB的可循環性一般,在極端溫度、高(放電)充電速率(高于1C)和高DoD(高于80%)均會減少電池循環次數。最近,研究人員在不同條件下探索了軟包和圓柱形SIB的循環性能。圖2d說明了75 Wh kg-1 SIB圓柱形電池在室溫下的長期循環性能。這些SIB表現出了出色的循環性,在1C速率和100% DoD下能接近4000次循環。LFP(磷酸鐵鋰離子電池)和NMC(鎳錳鈷鋰離子電池)在這些條件下的循環能力通常約為2000次循環。SIB的高溫可循環性也令人印象深刻,Novasis Energies軟包電池在45℃和1C速率下能進行200次循環且保持95%以上的容量保持率。因此,SIBs能夠在廣泛的環境條件下運行,并且它們的可循環性可與最先進的LIBs相媲美。
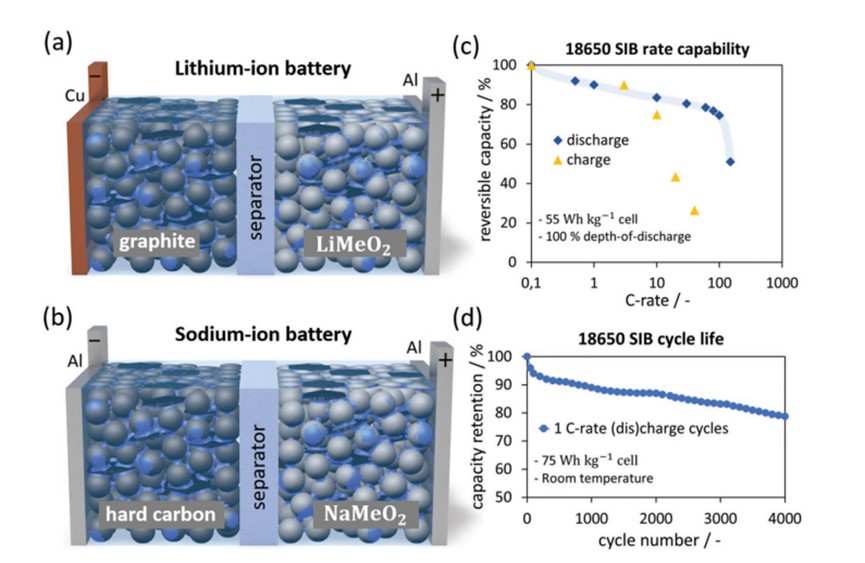
圖 2 a)鋰離子電池和 b)鈉離子電池的圖示,灰色球形為活性顆粒,黑色六邊形為碳導電填料,藍色為粘合劑。c)55Wh kg-1 SIB的倍率能力測試顯示出色的充放電率。d)SIB的延長循環壽命測試顯示在壽命結束前能夠進行約4000次循環。測試條件為室溫、1C速率和100% DoD下循環,電壓范圍為2~4.25V
3.4 安全性
科研人員已對軟包和18650 SIB電池進行了多項非常規使用耐受測試,例如擠壓、釘子穿透和加速量熱法(ARC)。圖3a顯示了進行釘子穿透的圓柱形SIB。圓柱形SIB需要10分鐘才能達到130℃的最高溫度。經過釘刺測試的Novasis Energies生產的軟包電池如圖3b所示。盡管釘子穿孔是可見的,但由于PBA陰極沒有產生氧氣,SIB在測試期間沒有著火。值得注意的是,對短路SIB進行的擠壓測試和釘刺測試均未顯示任何溫度變化,這證明了在0 V下運輸和儲存的重要性。
在ARC測試期間,電池逐漸加熱以評估其自熱溫度。自加熱溫度由溫度平臺指示,其中電池溫度由內部放熱反應維持。圖3c比較了NMC與基于HC//NaFe0.4Mn0.3Ni0.3O2的Sumitomo SIB的ARC測試。LIB的自加熱溫度較低(165℃),SIB的自加熱溫度較高(260℃),表明SIB具有優異的熱穩定性。圖3d比較了LCO(鈷酸鋰離子電池)和LFP與Faradion SIB電池的ARC測試。類似地,SIB顯示出自加熱的延遲啟動和顯著較低的自加熱速率。由于LIB火災的案例眾多,電池安全對電池運輸公司至關重要。尤其是航空公司,有義務遵守有關機載LIB的嚴格規定,這是在2013年發生兩次災難性LIB故障之后,迫使波音787 Dream班機停飛后修訂的。在SIB的情況下,全面的LIB法規已被擴展到SIB來適用。然而,正如安全測試結果所證明的那樣,SIB具有出色的熱穩定性和濫用耐受性。短路SIB的結果保證了SIB運輸法規的重新分類,專家可以借鑒短路非對稱電容器的法規,允許作為空運運輸。
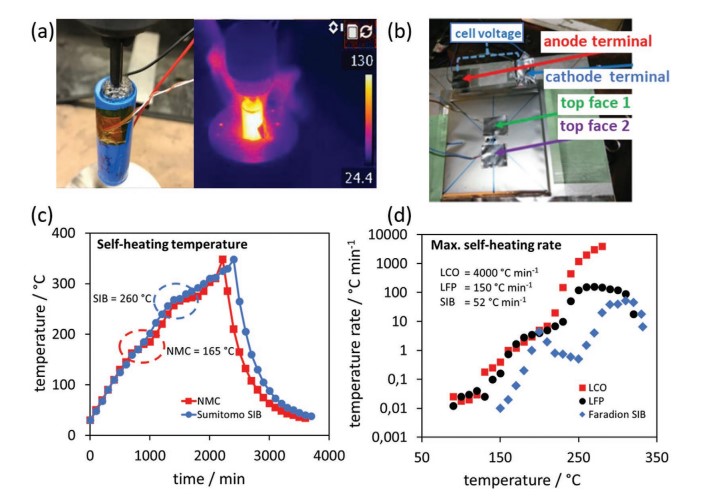
圖3 與商業LIB相比,SIB具有出色的熱穩定性和安全性。a) 圓柱形 SIBs 進行釘子穿透測試。b)在釘刺試驗后顯示無火焰的帶有四個熱電偶的SIB軟包電池。c)與NMC相比,SIB的ARC測試顯示SIB的自熱溫度較高。d)與LCO和LFP相比,SIB的ARC測試顯示SIB的自熱率較低。
3.5 成本
SIB因其在電網應用中的低成本潛力而引起了人們的興趣,成本因素一直是討論不斷的一個課題。由于兩種儲能技術的成熟度不同,基準測試任務變得困難。因此,應對此文中所使用的方法和得出的結果表示理解。Vaalma等人提出了一種簡單的方法,其中,LiMn2O2//合成石墨電池的組分被交換以構建假設的NaMn2O2//合成石墨電池。不考慮這樣的SIB電池是不可能運行的(因為Na無法嵌入石墨)這一事實,這種方法提供了材料成本的快速和合理的比較。結果表明,與類似的LIB相比,SIB的成本降低了約12.5%。
然而,電池成本分析不是一個簡單的材料成本問題,必須從整體角度考慮。電池設計、電極涂層厚度和孔隙率等輔助特性是重要的成本因素,其對成本的影響力度因電池化學性質而異。Novák及其同事應用能源成本模型來比較SIB和LIB的成本。該模型考慮了材料成本、加工成本和管理費用。HC//NVPF SIB電池的成本為320美元kWh-1,而石墨//LFP LIB電池的成本為280美元kWh-1。這表明,在當時盡管SIB每千瓦時的材料成本低廉,但SIB比LIB更昂貴。該成本包含電池處理成本和管理費用,使得該報告日期(2015年)的SIB成本更高。
更詳細的電池成本分析基于阿貢國家實驗室的BatPac模型。該模型包括電池設計特性、電池折舊以及除材料和加工成本之外的保修費用。許多研究已經在LIB 和最近的SIB成本分析中使用BatPac。Peters等人使用BatPac分析以確定由 Faradion配方活性材料(即HC//NMMT)組成的18650 SIB的成本。SIB、LFP和 NMC電池的計算成本分別為223、229和168歐元每千瓦時。因此,SIB電池比 LFP電池便宜,但不如NMC電池便宜。這些結果突出了電池成本分析的第二個重要因素,即活性材料的能量密度。高能量密度材料在降低每千瓦時的材料成本和達到目標電池能量的加工成本方面具有雙重作用。應該注意的是,在三個基準電池中,NMC使用的卻是最昂貴的材料。因此,制造具有成本競爭力的SIB的努力應該包括對高能量密度活性材料的探究。
3.6 電動汽車和固定應用
LIB的發展和大規模商業運用是BEV(純電動汽車)增長背后的動力。雖然LIB的高額定功率允許電動汽車快速加速,但行駛里程受到電池組容量的限制。因為在車輛的底盤內,可容納電池組的體積有限。電池重量不是BEV設計的首要考慮因素,因為高速公路上的行駛里程受空氣動力學影響。因此,BEV的里程焦慮問題可以通過阻力系數較小的車輛和體積能量密度較高的電池來解決。
基于能量成本模型,HC//NVPF SIB的體積能量密度約為400Wh L-1,而特斯拉BEV中使用的石墨//NCA電池的體積能量密度為≈700Wh L-1。很明顯,最先進的SIB 也無法很好的在BEV領域中替換LIB。然而,這并不是說SIB找不到這方面的其他應用,例如低速電動車和四輪微型車。中科海鈉率先開發了由SIB驅動的低速電動汽車。還值得一提的是分別由Tiamat和Faradion制造的演示電動滑板車和電動自行車。
在固定應用中,電池將在把可再生能源并入電網方面發揮關鍵作用。如前所述,儲能方面電池重量和占地面積雖不是主要因素,但LIB目前發揮主導作用。最近宣布了幾個大型電池裝置,值得注意的包括SAFT安裝的6.6 MWh (5.6 MW) LIB,該裝置將成為北歐國家最大的LIB,使用的是Tesla Megapack電池,這是一種容量高達3MWh的容器大小的LIB組。在SIBs方面,中科海鈉的100 kWh電池是目前最大的電池組。
電網應用的電池尺寸選擇是一個為給定的電網應用或占空比選擇正確的電池化學成分的問題。電網應用包括目前市場中的時移、擁塞緩解、靈活爬坡和頻率調節。在時移和擁塞緩解應用中,需要高電池容量,而在斜坡和頻率調節應用中,需要高電池功率。研究表明,在深放電應用中,SIB和LIB的電能存儲效率最高(90%以上),而鉛蓄電池和鎳鎘電池最低。由于每兆瓦時的收入與電池效率成線性比例,因此SIB和LIB的收入期望是最高的,從而解釋了對固定應用中LIB的興趣。然而,SIB的出色性能使得其可以應用在時移領域,因為它們具有如前所述的高DoD和長循環壽命。
4.SIB技術趨勢分析與展望
從目前的趨勢來看,LIBs確實會面臨來自資源的挑戰。最終,LIB需求將超過生產限制,導致價格上漲。雖然可以找到其他的鋰來源,例如鹽水鋰礦,但在低濃度鹽水中的提取成本過高,大約是當前成本的五倍。其他替代方案是LIB 回收,以及報廢BEV電池的電池壽命延長,因為它們在壽命結束時仍剩余約80%的標稱容量。值得一提的研究包括例如Umicore的超高溫 (UHT) 工藝,LIB的回收能力為每年7000噸,以及歐盟資助的用于二次電池的Circusol項目。但是,需要解決關于在電池回收中使用浸出化學品所帶來的環境問題。
然而,SIB技術可以提供可行的替代方案來填充LIB的應用領域,最有前途的是固定儲能應用。正如本文所敘述的,原型SIB在能量密度、倍率性能和循環性能方面可與最先進的LIB相媲美。此外,基于熱穩定性研究,SIBs的安全特性優于LIBs。盡管SIB通常更便宜,但就目前的材料成本而言,挑戰在于將加工成本提高到具有競爭力的水平。目前的策略包括使用厚電極涂層和較低鹽濃度的電解質,這兩種策略都利用了鈉基電解質更高的電導率。當SIB技術達到成熟水平時,形成的規模化產業鏈經濟有望進一步發揮重要作用。我們還應該強調SIB的長循環壽命,這可以抵消高額前期投資,并使它們在大規模固定應用中具有成本吸引力。
基于專利的技術趨勢分析通常遵循四個連續的階段:i)前期(新興),ii)起飛(成長),iii)加速(成熟),最后 iv)穩定(飽和)。開發前階段的特點是年度專利數量呈指數增長,而成長階段的特點是專利數量下降,因為公司已經在對技術進行整合和商業化。對LIB技術的專利趨勢分析顯示,LIB技術于2009年進入成熟階段。LIB的飽和階段仍有待觀察,因為電動汽車和固定存儲市場中的LIB新的應用領域不斷涌現。2017年首次對SIB技術進行了類似的分析。基于每年專利申請一直保持急劇的增長,可以得出結論,SIB技術仍處于新興階段。
但自2017年以來,SIB年度專利數量呈下降趨勢,標志著進入增長階段。專利數量的這種下降歸因于研究的縮減,因為公司開始專注于商業化。將這些專利趨勢與原型SIB中看到的積極結果相結合,有理由期待在不久的將來會迎來商業化SIB。
除了已經提到的公司之外,致力于SIB商業化的初創公司還包括Natron Energy(前身為 Alveo Energy)和 Altris AB。雖然處于資本早期階段的初創公司正在努力克服“Valley of Death”,但越來越多的公司卻展示了積極的跡象。這可能保證了SIB技術在未來幾年的成功和商業化。幾個歐盟資助的項目,如NAIADES、NAIMA、和Ecodesign Batteries,匯集了歐盟工業、研究機構和高校的貢獻以開發SIB。歐盟下一代電池的目標包括長循環壽命、可回收性提高(以用于循環經濟)以及關鍵原材料替代。到2030年,儲能成本預計將降至每周期0.05歐元kWh-1以下,SIB技術有望實現這些目標。
就發展藍圖而言,目前不同人似乎有著不同的看法。一些人希望SIBs最終取代 LIBs作為更便宜和資源豐富的替代品,而另一些人則認為沒有理由證明替代策略是合理的,而是認為SIBs應該被視為一個單獨的電池類別。從LIB的歷史發展中吸取的教訓可知,很明顯電池技術需要有著相匹配的應用,第一批LIB就說明了這一點,它與便攜式電子設備一起發展。為了避免為錯誤放置的政策提供技術解決方案的陷阱,重要的是確定目標應用領域并以最令人滿意的長期結果為目標。SIB技術趕上鋰離子電池這樣的成熟技術無疑是一項艱巨的任務。除此之外,在固態電池、可充電金屬-空氣電池、離子液體電池和水性電解質電池等領域跨越和超越LIBs是基礎研究的另一個機會,可以利用SIB獨特的特性用于未來的應用。
5.結論
那么,SIB能否最終取代LIB并獲得經濟上的競爭力?SIB在短時間內證明了其有著與LIB匹配的性能指標,并有可能在大規模固定應用中取代它們。SIBs以地球豐富的元素為基礎發展,能夠實現高性價比。SIBs的杰出性能還體現在功率、可循環性、可回收性和安全性(由于可放電到0V下存儲和運輸)方面。此外,專利趨勢的跡象表明,SIB已經從新興階段演變到了成長期階段。然而,由于每千瓦時的高成本以及在應用中與現有技術的直接競爭,SIB面臨商業化的嚴峻挑戰。
SIB研究的復興也離不開對可持續和環境友好的儲能解決方案的需求。展望未來,SIB在原型電池商業化成功的基礎上趕上LIB是有必要的。SIB與LIB細微的前沿差異可能會推動SIB超越LIB。這些都是基礎和應用研究中新發現的潛在途徑,還有待開發。
文獻來源:Kudakwashe Chayambuka, Grietus Mulder, Dmitri L. Danilov, and Peter H. L. Notten. Advanced Energy Materials. From Li-Ion Batteries toward Na-Ion Chemistries: Challenges and Opportunities
(中國粉體網編譯整理/波德)
注:圖片非商業用途,存在侵權請告知刪除!