中國粉體網訊 天津大學生命科學學院常津教授團隊將納米技術與光遺傳學技術結合,設計了一種新型的納米抗腫瘤光遺傳操控系統——研究人員向生物體表面照射脈沖式近紅外光,光線穿透深層組織,被稀土納米顆粒接收轉換為可見藍光,進而激活光感蛋白,最終精準觸發腫瘤細胞凋亡。這一系統的成功研發,有望提供一種惡性腫瘤“微創治療”新方式。介紹該成果的論文《近紅外光激活的上轉換光遺傳學納米系統用于腫瘤治療》已發表在納米領域知名期刊《ACS Nano》上。
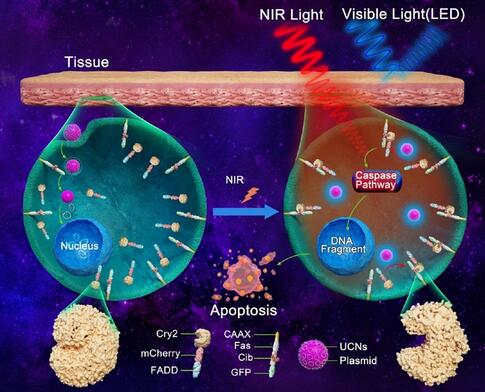
光遺傳學技術是通過光學控制激活或抑制受體細胞表達光敏感蛋白,從而實現對細胞活性乃至生理功能的精準調控,為本世紀最引人關注的生物技術之一。然而,長期以來,光遺傳學技術無法實現臨床轉化,主要因為應用時需要在活體中植入可見光光源,才能發揮作用。而植入光纖、LED燈等可見光源對生物體損傷較大,且有線設備的佩戴限制了生物體的活動。
常津教授團隊設計的這種納米抗腫瘤光遺傳操控系統,可以巧妙地利用稀土“建造”的納米顆粒作為細胞中的“能量中轉站”,將肉眼不可見、但能有效穿透人體組織的近紅外光轉換為可見的局部藍光,代替可見光源發揮功能,為光遺傳技術應用起到了推動作用。
實驗中,研究者向小鼠腫瘤部位注射了搭載光敏凋亡基因(Fas-Cib1+Cry2-FADD),摻雜造影劑釓(Gd)且負載熒光染料吲哚菁綠(ICG)的上轉換納米顆粒,并對小鼠進行了脈沖式近紅外光照射。結果顯示,照射4周后,小鼠腫瘤體積及重量顯著減小(200mm3,0.25g),并展示出更長的存活期(8周)。“稀土納米顆粒結合光遺傳學技術用于腫瘤靶向可視化治療,具備微創性、深層組織穿透性及強操控性等特點。未來有望通過在顆粒中摻雜不同稀土元素及改造光感功能蛋白,實現對多重細胞通路的操控。”常津教授說。
(中國粉體網編輯整理/平安)