中國粉體網訊 近日,上海藥物所藥物制劑研究中心研究團隊創新性地設計、構建了一種細胞內酸敏感型多功能納米膠束共輸送光敏劑和化療藥物阿霉素前藥,初步實現了腫瘤光療和化療有機結合克服腫瘤耐藥。本研究于2016年2月15日在線發表于國際權威期刊ACS Nano。
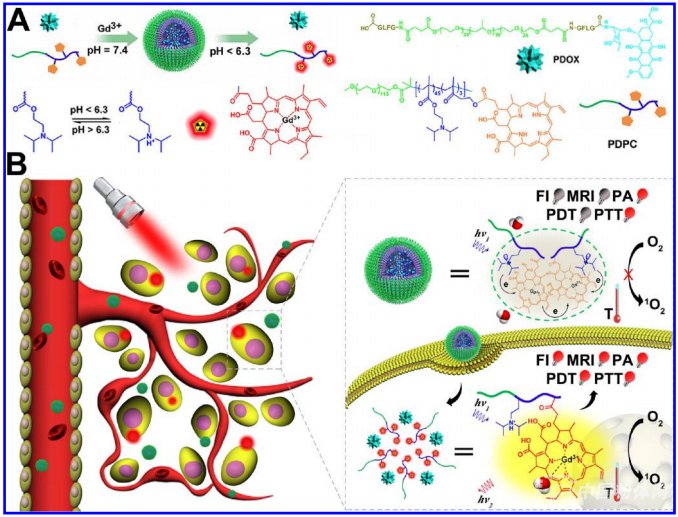
腫瘤多藥耐藥是癌癥治療面臨的一項重大挑戰,據報道超過90%的化療患者都會產生自發或獲得性耐藥,耐藥是造成臨床化療失敗的主要原因。研究表明,腫瘤耐藥與腫瘤存在一系列生理屏障密切相關。腫瘤組織存在致密成纖維細胞包膜,同時淋巴引流系統缺失,導致瘤內滲透壓升高,限制藥物向瘤內擴散。同時,耐藥腫瘤細胞的酸性溶酶體數量增加,形成離子陷阱。弱堿性抗癌藥物(如鹽酸阿霉素和鹽酸伊立替康等)會被束縛在溶酶體中并失去藥效。而腫瘤細胞長時間經受亞致死劑量的藥物刺激,是導致腫瘤產生獲得性耐藥的重要原因之一。長期以來,科研人員致力于開發納米遞藥系統,期望改善化療藥物在腫瘤組織的分布,抑制藥物外排,從而克服耐藥。但是因為存在上述腫瘤生理屏障,并沒有取得滿意進展。
上海藥物所的研究人員應用酸敏感聚合物載體、小分子光敏劑Ce6和大分子阿霉素前藥自組裝形成聚合物膠束。納米膠束可在正常生理環境中(pH 7.4)保持“沉默”,在進入腫瘤細胞溶酶體環境后(pH≤6.2)實現酸激活,發揮多模態成像和協同治療作用,并促進化療藥滲透殺傷耐藥細胞。利用Ce6的理化特性,可實現酸激活的熒光成像和光聲成像,實現耐藥腫瘤的多模態成像;而Ce6介導的光熱、光動力治療作用可有效增強阿霉素前藥的腫瘤組織穿透能力,與化療作用一起聯合殺傷耐藥細胞,克服腫瘤耐藥。在耐受阿霉素的乳腺癌MCF-7/ADR細胞和活體移植瘤模型上的研究顯示,這種新型納米遞藥系統能夠顯著抑制腫瘤生長,同時實現多模態成像和治療,為克服耐藥腫瘤提供了新思路。
本研究工作得到國家科技部“973”計劃和國家自然科學基金的支持。

腫瘤多藥耐藥是癌癥治療面臨的一項重大挑戰,據報道超過90%的化療患者都會產生自發或獲得性耐藥,耐藥是造成臨床化療失敗的主要原因。研究表明,腫瘤耐藥與腫瘤存在一系列生理屏障密切相關。腫瘤組織存在致密成纖維細胞包膜,同時淋巴引流系統缺失,導致瘤內滲透壓升高,限制藥物向瘤內擴散。同時,耐藥腫瘤細胞的酸性溶酶體數量增加,形成離子陷阱。弱堿性抗癌藥物(如鹽酸阿霉素和鹽酸伊立替康等)會被束縛在溶酶體中并失去藥效。而腫瘤細胞長時間經受亞致死劑量的藥物刺激,是導致腫瘤產生獲得性耐藥的重要原因之一。長期以來,科研人員致力于開發納米遞藥系統,期望改善化療藥物在腫瘤組織的分布,抑制藥物外排,從而克服耐藥。但是因為存在上述腫瘤生理屏障,并沒有取得滿意進展。
上海藥物所的研究人員應用酸敏感聚合物載體、小分子光敏劑Ce6和大分子阿霉素前藥自組裝形成聚合物膠束。納米膠束可在正常生理環境中(pH 7.4)保持“沉默”,在進入腫瘤細胞溶酶體環境后(pH≤6.2)實現酸激活,發揮多模態成像和協同治療作用,并促進化療藥滲透殺傷耐藥細胞。利用Ce6的理化特性,可實現酸激活的熒光成像和光聲成像,實現耐藥腫瘤的多模態成像;而Ce6介導的光熱、光動力治療作用可有效增強阿霉素前藥的腫瘤組織穿透能力,與化療作用一起聯合殺傷耐藥細胞,克服腫瘤耐藥。在耐受阿霉素的乳腺癌MCF-7/ADR細胞和活體移植瘤模型上的研究顯示,這種新型納米遞藥系統能夠顯著抑制腫瘤生長,同時實現多模態成像和治療,為克服耐藥腫瘤提供了新思路。
本研究工作得到國家科技部“973”計劃和國家自然科學基金的支持。